
摘 要: 蛋白质吸附、钙磷离子释放和表面生物矿化是钙磷材料诱导异位骨生成的可能材料机制。对比了非表 面微孔羟基磷灰石陶瓷(HA-S)、表面微孔羟基磷灰石陶瓷(HA-R)和表面微孔生物惰性非钙磷陶瓷(TiO2 陶瓷; 氧化铝陶瓷;两者无钙磷释放,无表面生物矿化能力)的异位骨诱导能力。研究发现,不同化学成分的陶瓷材料对 蛋白质有选择性吸附。即使不吸附骨形态发生蛋白-2(rhBMP-2),具有表面微孔的非钙磷陶瓷也能诱导异位骨 组织生成。结果表明,钙磷离子释放和表面生物矿化在磷酸钙生物材料骨诱导中不起关键作用,表面微孔也不一 定通过蛋白质吸附而在异位骨诱导中起作用。
0 引 言
发生在非骨部位的骨再生生物学过程叫骨诱导, 骨诱导较的例子是含有骨形态发生蛋白(BMP) 的种植体在软组织中的骨组织生成。在不加生长 因子的情况下,具有特殊物理化学特性的磷酸钙陶瓷 也具有骨诱导能力。其中,材料表面微孔性扮演重 要角色。具有表面微孔的羟基磷灰石陶瓷在肌肉种植 后能够诱导骨组织生成,但是没有表面微孔的羟基磷 灰石陶瓷没有骨诱导能力。
由于磷酸钙材料对骨形态发生蛋白(BMP)有较 强的吸附能力,具有表面微孔的磷酸钙陶瓷的骨诱导 作用通常被解释为微孔扩大了磷酸钙陶瓷的表面积, 从而可以从体液中吸附更多的蛋白质(包括骨诱导因 子如BMP),而这些被吸附在钙磷陶瓷表面的蛋白质 骨诱导因子较终诱发了骨组织形成。
另外近年来发现钙,磷离子对多潜能干细胞的骨 相分化有促进作用。磷酸钙陶瓷表面微孔在骨诱 导中的作用也被解释为微孔增加磷酸钙陶瓷的表面 积,从而有利于钙磷离子的释放,释放的钙磷离子可能 引发骨诱导。
磷酸钙材料是典型的生物活性材料。在体液中磷 酸钙陶瓷材料能在其表面形成类骨磷灰石层。磷 灰石层的形成以及在磷灰石层形成过程中参与进来的蛋白质(包括生长因子)也被认为是磷酸钙陶瓷骨诱导 的可能原因。
本文考察了不具备表面微孔的羟基磷灰石陶瓷 (HA-S),具备表面微孔的羟基磷灰石陶瓷(HA-R), 具备表面微孔的TiO2 陶瓷和氧化铝 陶瓷的蛋白吸附 能力,并比较这些陶瓷材料的异位成骨能力。以期论 证蛋白质吸附,钙磷离子释放和表面生物矿化在生物 材料异位骨诱导中的可能作用。
1 实 验
1.1 材料制备
陶瓷材料用双氧水发泡,并在高温下烧结制备。 具体来说,羟基磷灰石粉末(Merck,Germany),二氧化 钛粉末(Fluka,Switzerland)以及三氧化二铝粉末 (Fluka,Switzerland),分别用稀释的双氧水溶液(2% (质量分数))混合均匀,然后在60℃进行发泡和干燥, 制备成陶瓷坯体。HA胚体在1 250℃烧结8h得到 非微孔的的羟基磷灰石陶瓷(HA-S),在1100℃烧结 8h得到微孔的羟基磷灰石陶瓷(HA-R)。TiO2 陶瓷 在1200℃烧结200min,氧化铝 陶瓷在1300℃烧结 10h。烧结后的陶瓷块加工成直径为5mm,长度为 6mm的柱状样品,然后分别用丙酮,70%(质量分数) 乙醇和去离子水很声清洗,干燥后在121 ℃下灭菌 30min。
1.2 材料表征
用X射线衍射仪(X’Pertpro-MPD,the Netherlands) 分析陶瓷材料的化学成分;对材料的表面结构 进行扫描电镜(HITACHI S4800,Japan)观察;用BET (TristarⅡ3020,America)方法检测陶瓷材料的表面 积。
1.3 牛血清蛋白(BSA)和溶菌酶素(lysozyme)的吸 附
将陶瓷样品(n=3)分别浸泡在3mL含有25× 10-6叠氮化钠(NaN3)和200μg/mL牛血清蛋白(Fluka, Switzerland)或者20μg/mL 溶菌酶素(Fluka, Switzerland)或者1%(质量分数)胎牛血清(FBS, GibcoTM,Invitrogen corporation,UK)溶液中,并在 37℃水浴中震荡。7d后,将样品离心(3 000r/min) 5min,取上清液作蛋白分析。用BCA 蛋白浓度检测 法(Micro BCATMprotein assay kit,pierce biotechnology, rockford,IL,USA)检测蛋白质,并用相应蛋白 的标准曲线计算蛋白浓度。
1.4 rhBMP-2的吸附 将4种陶瓷样品(n=3)浸泡在3mL含有500ng rhBMP-2/mL(Huadong East-China pharmaceutical group investment Co.Ltd,Hangzhou,China)的细胞 培养液中。细胞培养液由DMEM(GibcoTM,Invitrogen corporation,UK),10% 胎牛血清(FBS)(GibcoTM, Invitrogen corporation,UK),100μg/mL盘尼西林和100μg/mL链霉素组成。样品在37 ℃,5% CO2 培养箱中孵化24h后,用磷酸盐缓冲液(pH 值= 7.4)润洗3次,并保存在-80℃。12h后每个样品添 加0.5mL 1% Triton并在4℃冰箱保存。12h后,样 品在很声波水浴中处理5min。离心(X3 000r/min) 5min,依照rhBMP-2酶联免疫反应测定法(rhBMP-2 Elisa,R&D,UK)测定上清液中的rhBMP-2蛋白浓 度。
1.5 动物实验
6条成熟雄性狗(体重为10~15kg)在本地购买。 麻醉(戊巴比妥钠(30mg/kg)),消毒(酒精,碘伏)后, 在狗背部用手术刀划开一个纵向皮肤切口并暴露肌 肉,再钝性分开肌肉成袋状,将样品植入肌肉袋中。
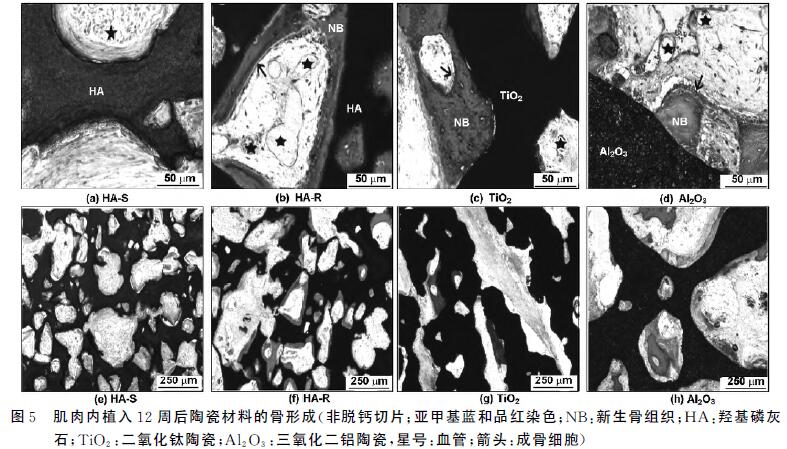
4个单独的肌肉袋间隔2cm 左右,每个肌肉袋中种植 一个样品。手术后,肌肉连续注射青霉素3d,防止感 染。12周后,用过量的戊巴比妥钠处死动物,取出样 品并固定在4%的福尔马林溶液中(pH 值=7.4)。 1周后,取出样品,用PBS冲洗,梯度酒精(70%,85%, 90%,95%,100%×2)脱水,MMA包埋。硬组织切片 机(Leica SP-1600,Germany)切片(10~20μm)。亚 甲基蓝和品红染色后,作定性和定量的组织学观察。
为了组织形态学分析,切片首先用扫描仪(Dimage Scan Elite 5400II,Japan)扫描,然后用PhotoshopCS5 处理图片,读出选中区域、材料、骨头三者的像素值,根 据公式

计算陶瓷材料大孔中的成骨量和材料在样品中的 百分比。用光学显微镜(Nikon Eclipse E200,Tokyo, Japan)观察样品中的组织成分(血管,新生骨组织和成 骨细胞)。
1.6 统计学分析
数据均采用平均值加减标准方差的形式表达。用 量化Turkey对比对数据进行单因素方差统计分析,p <0.05被认定为显著性差异。
2 结果与讨论
2.1 材料表征
材料的XRD图谱如图1所示。由图1可知,HAS 和HA-R在不同温度烧结(HA-S,1250℃;HA-R, 1100℃),但它们的特征峰与标准羟基磷灰石一致。 TiO2 在2θ=27.6,36.28,41.4,54.5,56.78和69.16°有 明显的特征衍射峰,与r-TiO2 的XRD 标准峰一致。
氧化铝 在2θ=25.7,35.3,37.9,43.48,52.68,57.62, 66.62和68.32°处有明显的特征衍射峰,与α-氧化铝 的 XRD标准峰一致。
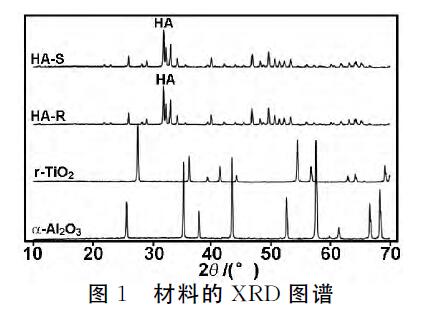
从图1可知,1 250℃烧结后,HA晶体熔融在一起,导致HA-S形成较光滑的表面(图2(a)),但是 1 100℃烧结的HA-R表面有丰富的微孔(图2(b))。 TiO2 表面同样可以看到丰富的微孔(图2(c))。在 1 300℃下,很少氧化铝 晶体(细微颗粒)熔融,颗粒堆 叠在一起形成微孔(图2(d))。BET 无法检测HA-S 表面积,HA-R的表面面积为0.777m2/mL,TiO2 的 表面面积为0.102m2/mL,氧化铝 为0.206m2/mL(表 1)。4种不同的微孔表面结构,材料的表面积不同。
2.2 蛋白吸附
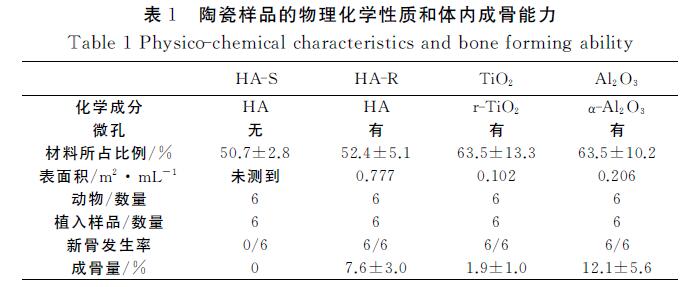
浸泡7d后,不同材料吸附牛血清蛋白(BSA)的 能力各不相同(图3(a))。HA-S吸附(64±8)μg BSA (占总BSA的(11±1)%),HA-R吸附(485±5)μg BSA(占总BSA的(81±1)%),TiO2 吸附(182±12)μg BSA (占总BSA 的(30±2)%),氧化铝 吸附(217±16)μg BSA(占总BSA的(36±3)%)。

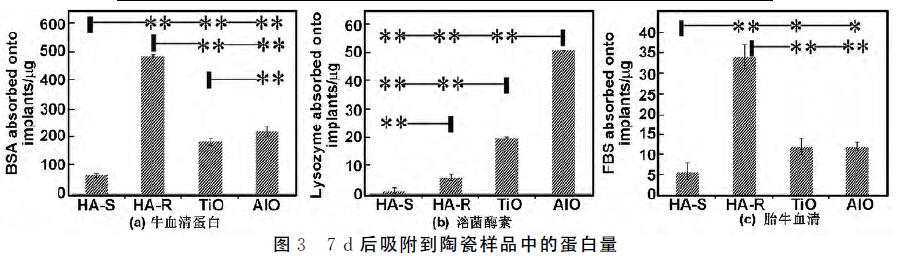
浸泡7d后,不同材料吸附溶菌酶素(lysozyme) 的能力各不相同(图3(b))。氧化铝 能吸附溶菌酶素 较多,HA±S吸附较少。HA±S吸附(1±1)μg(占总 量(2±2)%),HA±R 吸附(6±1)μg(占总量(10± 2)%)。TiO2 吸附(20±1)μg(占总量(33±1)%)。
氧化铝 吸附(51±1)μg(占总量(85±1)%)。 浸泡7d后,不同材料吸附FBS的能力也不一样 (图3(c))。HA-S吸附较少(占总量的6%),HA-R吸 附较多(占总量的34%),TiO2 和氧化铝 吸附的量大 致一致(分别占总量的12%和12%)。
陶瓷材料化学成分不一样,蛋白质吸附能力不同。 微孔的HA-R总比无微孔的HA-S吸附更多的蛋白 质,说明对于同一材料,蛋白质吸附与材料微孔和表面 积有关。
2.3 rhBMP-2吸附
HA对rhBMP-2有很强的吸附能力,与微孔和表 面积有关,而TiO2 和氧化铝 陶瓷对rhBMP-2的吸附 能力很弱(图4所示)。
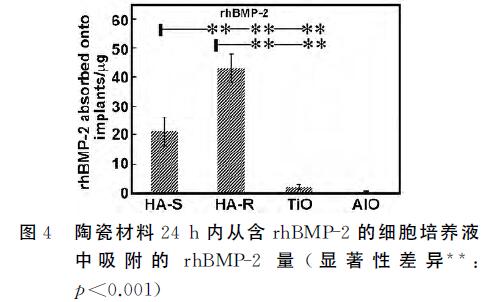
浸泡24h后,HA-S吸收(21.4±4.6)ng rhBMP-2 (占总量的(1.40±0.33)%),HA-R 吸收(42.9±5.3)ng rhBMP-2(占总量的(2.87±0.33)%),TiO2 吸收 (2.2±0.8)ng rhBMP-2(占总量的(0.13±0.06)%), 氧化铝 吸附(0.4±0.2)ng rhBMP-2(占总量的(0.02± 0.01)%)。这个结果验证了钙磷陶瓷对BMP有较强 的亲和力,但结果也同时显示TiO2 和氧化铝 陶瓷对 rhBMP-2的吸附能力很弱。
2.4 陶瓷材料的成骨能力
肌肉种植12周后,所有HA-R,TiO2,氧化铝 植入 体都有骨组织生成,但在HA-S中没有骨生成(表1)。 在HA-S里只发现纤维组织和血管(图5(a),(e))。除 了纤维组织和血管外,在HA-R的大孔表面还发现有 矿化的骨组织(图5(b),(f))。与HA-R 类似,TiO2 (图5(c),(g))和氧化铝(图5(d),(h))大孔中有纤维 组织,血管和新生骨组织。
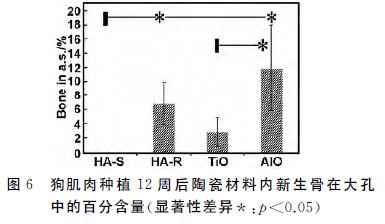
组织形态定量分析总结在图6和表1,陶瓷种植 体具有不同材料百分比。HA-S中材料占(50.7± 2.8)%,HA-R中材料占(52.4±5.1)%,TiO2 中材料 占(63.5±13.3)%,氧化铝 中材料占(63.5±10.2)%。 样品中的成骨量也有差异。HA-R中成骨量为(7.6± 3.0)%,TiO2 中成骨量为(1.9±1.0)%,氧化铝 中成骨量 为(12.1±5.6)%。由于制备陶瓷的材料百分比不同 (表1),陶瓷有不同的孔隙率,因而无法排除大孔孔隙 率对成骨量的可能影响。但单从新骨发生率的不同, 可以讨论材料因素在生物材料骨诱导中的可能功能。
HA-R能够吸附更多的rhBMP-2,TiO2 和氧化铝 陶瓷几乎不吸附rhBMP-2(图4),而它们都能诱导骨生成(表1,图5和6)。不同化学组分的陶瓷材料蛋白 质吸附(图3和4)和成骨能力的比较不能明确蛋白质吸附在生物材料骨诱导中的关键作用。 由于钙磷离子分别对多潜能干细胞的骨相分化有 促进作用,钙磷离子释放也通常作为解释磷酸钙陶瓷 诱导成骨的原因之一[4]。本文中,骨组织再生除了发 生在微孔结构的HA-R 里,也发生微孔TiO2 和 氧化铝 陶瓷里。因为TiO2 和氧化铝 陶瓷根本无法释 放出钙磷离子,所以这个结果否定了钙磷离子在骨诱 导中的关键作用。
由于钙磷离子释放和重新表面沉积,材料表面形 成类骨磷灰石层,从而使磷酸钙陶瓷具有生物活性。在类骨磷灰石层形成过程中,体液中的生长因 子参与生物矿化,从而引起生物反应,这也被用来解释 磷酸钙陶瓷骨诱导现象。单纯的TiO2 和氧化铝陶瓷是典型的生物惰性材料,不会在模拟体液中形成表面类骨磷灰石层。所以,TiO2和氧化铝陶瓷诱导成骨 的结果否定了生物矿化在生物材料诱导成骨中的关键 作用。 近年来,生物材料的表面物理特性的生物效应研 究取得进展。多潜能干细胞可能根据材料表面微 孔结构而改变它们的形态,而这种细胞形态改变引起 细胞的骨相分化。特异的生物材料表面微孔可能直接诱导骨组织生成。
3 结 论
(1) SEM 和BET的测试结果发现,以双氧水为 发泡剂,高温烧结而成的4种陶瓷具有不同的表面结 构和表面积。
(2) 不同化学组分的陶瓷材料蛋白质吸附和成 骨能力的比较不能明确蛋白质吸附在生物材料骨诱导 中的关键作用。
(3) TiO2 和氧化铝陶瓷诱导成骨的结果表明微 孔并不是通过钙磷离子释放和表面生物矿化而起作 用,也不一定通过蛋白质吸附引起骨诱导。